
| student study |
| of school |
单项选择题:本题包括10小题,每小题2分, 共计20分。每小题只有一个选项符合题意。
1.2017 年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法应提倡的是
| A.夏天设定空调温度尽可能低 | B.推广使用一次性塑料袋和纸巾 | C.少开私家车多乘公共交通工具 | D.对商品豪华包装促进销售 |
2.下列有关化学用语表示正确的是
| A.质量数为31的磷原子: P | B.氟原子的结构示意图: | C.CaCl2 的电子式:Ca2+[ Cl ]-2 | D.明矾的化学式: Al2(SO4)3 |
3.下列有关物质性质与用途具有对应关系的是
A.Na2O2 吸收CO2 产生O2,可用作呼吸面具供氧剂 B.ClO2 具有还原性,可用于自来水的杀菌消毒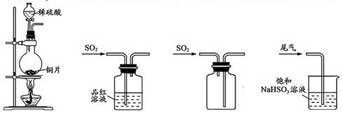
C.SiO2 硬度大,可用于制造光导纤维 D.NH3 易溶于水,可用作制冷剂
4.制取SO2 、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是
A.制取SO2 B.验证漂白性C.收集SO2D.尾气处理
5.短周期主族元素X、Y、Z、W 原子序数依次增大,只有Y、Z 处于同一周期且相邻,Z 是地壳中含量最多的元素,W 是短周期中金属性最强的元素。说法正确的是
| A.原子半径: r(X) < r(Y) < r(Z) < r(W) | B.W 的最高价氧化物的水化物是一种弱碱 | |
| C.Y 的单质的氧化性比Z 的强 | D.X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
6.下列指定反应的离子方程式正确的是 A. 钠与水反应: Na + 2H2O = Na+ + 2OH- + H2↑
B. 电解饱和食盐水获取烧碱和氯气: 2Cl- + 2H2O = H2↑ + Cl2↑ + 2OH-
C. 向氢氧化钡溶液中加入稀硫酸: Ba2+ + OH + H+ + SO![]() = BaSO4↓ + H2O
= BaSO4↓ + H2O
D. 向碳酸氢铵溶液中加入足量石灰水: Ca2+ + HCO![]() + OH = CaCO3↓ + H2O
+ OH = CaCO3↓ + H2O
7.给定条件下,下列选项物质间转化均能实现的是
8.以下反应可获得能源二甲醚(CH3OCH3)。说法不正确的是
| ① C(s) + H2O(g) = CO(g) + H2(g) | ΔH1 = a kJ·mol-1 | ② CO(g) + H2O(g) = CO2(g) + H2(g) | ΔH2 = b kJ·mol-1 | |
| ③ CO2(g) + 3H2(g) = CH3OH(g)+H2O(g) | ΔH3 = c kJ·mol-1 | ④ 2CH3OH(g) =CH3OCH3(g)+H2O(g) | ΔH4 = d kJ·mol-1 |
A. 反应①、②为反应③提供原料气 B. 反应③也是CO2 资源化利用的方法之一
C. 反应CH3OH(g) = 1/2 CH3OCH3(g) + 1/2 H2O (1) 的 ΔH = d/2 kJ·mol-1
D. 反应2CO(g) + 4H2(g) = CH3OCH3(g) + H2O(g) 的 ΔH = (2b + 2c + d)kJ·mol-1
9.常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中: Fe3+ 、Mg2+ 、SCN、Cl- B. c(H+) / c(OH-) =1×10-12 的溶液中: K+ 、Na+ 、O![]() 、NO
、NO![]()
C. c (Fe2+ ) = 1mol·L-1 的溶液中: K+ 、NH![]() 、MnO
、MnO![]() 、SO
、SO![]() D. 能使甲基橙变红的溶液中: Na+ 、NH
D. 能使甲基橙变红的溶液中: Na+ 、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
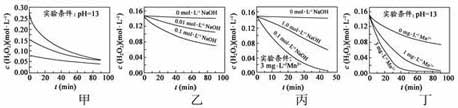
10.H2O2 分解速率受多种因素影响。实验测得 70℃ 时不同条件下H2O2 浓度随时间的变化如图所示。下列说法正确的是
A. 甲表明,其他条件相同时,H2O2 浓度越小,其分解速率越快 B. 乙表明,其他条件相同时,溶液pH 越小,H2O2 分解速率越快
C. 丙表明,少量Mn2+ 存在时,溶液碱性越强,H2O2分解速率越快 D. 丙和丁表明,碱性溶液中,Mn2+对H2O2 分解速率的影响大
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。选错一个,该小题得0分。
11.萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是 ![]()
A. a 和b 都属于芳香族化合物 B. a 和c 分子中所有碳原子均处于同一平面上
C. a、b和c 均能使酸性KMnO4 溶液褪色 D. b 和c 均能与新制的Cu(OH)2 反应生成红色沉淀
12.下列说法正确的是 A. 反应N2(g) + 3H2(g) = 2NH3(g) 的 ΔH < 0,ΔS > 0
B. 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C. 常温下,Ksp[ Mg(OH)2 ] = 5.6×10-12 , pH=10 的含Mg2+ 溶液中, c(Mg2+ ) ≤ 5.6×10-4 mol·L-1
D. 常温常压下,锌与稀H2SO4 反应生成11.2L H2,反应中转移的电子数为 6.02×1023
13.根据下列实验操作和现象所得到的结论正确的是 A. 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 。苯酚浓度小
B. 向久置的Na2SO3 溶液中加入足量BaCl2 溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 。部分Na2SO3 被氧化
C. 向20%蔗糖溶液中加入少量稀H2SO4 ,加热;再加入银氨溶液;未出现银镜 。蔗糖未水解
D. 向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色 。溶液中含Br2
14.常温下,Ka(HCOOH) = 1.77×10-4,Ka(CH3COOH) = 1.75×10-5,Kb(NH3·H2O ) = 1.76×10-5,下列说法正确的是
A. 浓度均为0.1mol·L-1 的HCOONa 和NH4Cl 溶液中阳离子的物质的量浓度之和: 前者大于后者
B. 用相同浓度的NaOH 溶液分别滴定等体积pH 均为3的HCOOH 和CH3COOH 溶液至终点,消耗NaOH 溶液的体积相等
C. 0.2mol·L-1 HCOOH 与0.1mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2mol·L-1 CH3COONa 与0.1mol·L-1 盐酸等体积混合后的溶液中(pH < 7): c(CH3COO-) > c(Cl-) > c(CH3COOH) > c(H+)
15.温度为T1 时,在三个容积均为1L 的恒容密闭容器中仅发生反应: 2NO2(g) ![]() 2NO(g) + O2(g) (正反应吸热)。实验测得: v正 = v(NO2)消耗 = k正 c2(NO2),v逆 = v(NO)消耗 =2v(O2)消耗 = k逆 c2(NO)·c(O2),k正 、k逆 为速率常数,受温度影响。 下列说法正确的是
2NO(g) + O2(g) (正反应吸热)。实验测得: v正 = v(NO2)消耗 = k正 c2(NO2),v逆 = v(NO)消耗 =2v(O2)消耗 = k逆 c2(NO)·c(O2),k正 、k逆 为速率常数,受温度影响。 下列说法正确的是
容器Ⅰ:c(NO2)起始浓度0.6,c(NO)起始浓度0,c(O2起始浓度0,c(O2平衡浓度0.2。容器Ⅱ:c(NO2)起始浓度0.3,c(NO)起始浓度0.5,c(O2起始浓度0.2。容器Ⅲ:c(NO2)起始浓度0,c(NO)起始浓度0.5,c(O2起始浓度0.35。
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5 B.达平衡时,容器Ⅱ中c(O2) / c(NO2 ) 比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中NO 的体积分数小于50% D.当温度改变为T2 时,若k正 = k逆,则 T2 > T1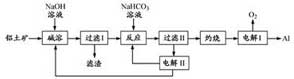
16.(12分)以铝土矿(主要成分为Al2O3,含SiO2 和Fe2O3 等杂质)为原料制备铝流程如下:
注: SiO2 在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为____▲____。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3 溶液,溶液的pH___▲___(填增大、不变或减小)。
(3)“电解Ⅰ”是电解熔融A2lO3,电解过程中作阳极的石墨易消耗,原因是___▲__。 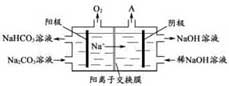
(4)“电解Ⅱ”是电解Na2CO3 溶液,原理如图所示。
阳极的电极反应式为___▲___,阴极产生的物质A的化学式为____▲____。
(5)铝粉在1000℃ 时可与N2 反应制备AIN 。在铝粉中添加少量NH4Cl 固体并充分混合,有利于AIN 的制备,其主要原因是__▲__。
17.(15分)化合物H 是一种用于合成γ -分泌调节剂的药物中间体,其合成路线流程图如下: 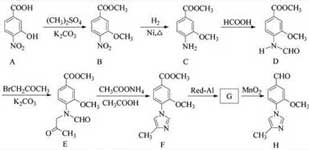
(1)C 中的含氧官能团名称为__▲__和__▲__。 (2)D→E 的反应类型为___▲___。
(3)写出同时满足下列条件的C 的一种同分异构体的结构简式:____▲____。
①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2 ,经氧化得到H,写出G 的结构简式:____▲____。
(5)已知: ![]() (R 代表烃基,R´ 代表烃基或H) ,写出以
(R 代表烃基,R´ 代表烃基或H) ,写出以![]() 和(CH3)2SO4 为原料制备
和(CH3)2SO4 为原料制备![]() 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
18.(12 分)碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
① 方法1: 45~50℃ 时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O, 该反应的化学方程式为__▲_。
② 方法2: 先制得CuCl2 ,再与石灰乳反应生成碱式氯化铜。Cu 与稀盐酸在持续通入空气的条件下反应生成CuCl2 ,Fe3+ 对该反应有催化作用,其催化原理如图所示。 M´ 的化学式为____▲____。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成, 进行下列实验: ①称取样品1.1160 g,用少量稀HNO3 溶解后配成100.00 mL 溶液A; ②取25.00 mL 溶液A,加入足量AgNO3 溶液,得AgCl 0.1722 g;③另取25.00 mL 溶液A ,调节pH 4 ~5,用浓度为0.08000 mol·L-1 的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2+ + H2Y2- = CuY2- + 2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)。
19.(15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag (其他金属影响忽略)。
已知:① NaClO 溶液在受热或酸性条件下易分解,如:3NaClO=2NaCl+NaClO3
② AgCl 可溶于氨水: AgCl + 2NH3·H2O ![]() Ag(NH3)
Ag(NH3)![]() + Cl- + 2H2O
+ Cl- + 2H2O
③ 常温时N2H4·H2O (水合肼)在碱性条件下能还原Ag(NH3)![]() : 4Ag(NH3)
: 4Ag(NH3)![]() +N2H4·H2O =4Ag↓ +N2↑ + 4NH
+N2H4·H2O =4Ag↓ +N2↑ + 4NH![]() + 4NH3↑ +H2O
+ 4NH3↑ +H2O
(1)“氧化”阶段需在80℃ 条件下进行,适宜的加热方式为_____▲_____。
(2)NaClO 溶液与Ag 反应的产物为AgCl 、NaOH 和O2,该反应的化学方程式为_____▲_____。
HNO3 也能氧化Ag ,从反应产物的角度分析,以HNO3 代替NaClO 的缺点是____▲____。
(3)为提高Ag 的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_____▲______。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO 与NH3·H2O 反应外(该条件下NaClO3 与NH3·H2O不反应),还因为____▲____。
(5)设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:__▲__(实验中须使用的试剂有: 2 mol·L-1水合肼溶液,1 mol·L-1 H2SO4)。
20.(14分)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使充分反应,获得砷的高效吸附剂X,吸附剂X 中含O![]() ,原因是__▲__。
,原因是__▲__。
(2)H3AsO3 和H3AsO4水溶液中含砷各物种的分布分数与pH关系分别如20图- 1和20图- 2示。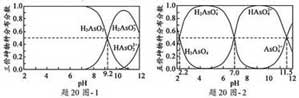
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH 溶液逐滴加入到H3AsO3 溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为___▲____。
②H3AsO4 第一步电离方程式H3AsO4 ![]() H3AsO
H3AsO![]() + H+ 的电离常数为Ka1,则pKa1=____▲_____( pKa1 = -1g Ka1)。
+ H+ 的电离常数为Ka1,则pKa1=____▲_____( pKa1 = -1g Ka1)。
(3)溶液pH 对吸附剂X表面带电荷有影响。pH =7.1时,吸附剂X 表面不带电荷; pH > 7.1时带负电荷,pH 越高,表面带负电荷越多;pH<7.1时带正电荷,pH 越低,表面带正电荷越多。pH不同时吸附剂X 对三价砷和五价 砷的平衡吸附量如20图-3示。
砷的平衡吸附量如20图-3示。
①在pH7~9之间,吸附剂X 对五价砷的平衡吸附量随pH 升高而迅速下降,其原因是____▲___。
②在pH4~7之间,吸附剂X 对水中三价砷的去除能力远比五价砷的弱,这是因为____▲___。提高吸附剂X 对三价砷去除效果可采取的措施是___▲___。
21. (12 分)【选做题】本题包括A、B两小题,选其中一小题,并在相应答题区内作答。若多做,则按A小题评分。
A. [物质结构与性质] 铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy 的制备需铁、氮气、丙酮和乙醇参与。 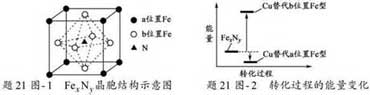
(1)Fe3+ 基态核外电子排布式为____▲_____。
(2)丙酮(H3C-CO-CH3)分子中碳原子轨道的杂化类型是_____▲_____,1mol 丙酮分子中含有σ 键的数目为_____▲____。
(3)C、H、O 三种元素的电负性由小到大的顺序为_____▲_____。
(4)乙醇的沸点高于丙酮,这是因为____▲_____。
(5)某FexNy 的晶胞如题21图-1所示,Cu 可以完全替代该晶体中a 位置Fe 或者b 位置Fe,形成Cu 替代型产物Fe(x-n)CunNy。FexNy 转化为两种Cu 替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu 替代型产物的化学式为____▲_____。
B. [实验化学] 1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36 g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1: 在仪器A 中加入搅拌磁子、12g正丙醇及20ml 水,冰水冷却下缓慢加入28mL浓H2SO4 ;冷却至室温,搅拌下加入24g NaBr。
步骤2: 如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。 步骤3: 将馏出液转入分液漏斗,分出有机相。
步骤4: 将有机相转入分液漏斗,依次用12mL H2O、12mL 5% Na2CO3 溶液和12mL H2O洗涤分液,得粗产品,提纯得1-溴丙烷。
(1)仪器A 的名称是___▲___;加入搅拌磁子的目的是搅拌和__▲___。 (2)反应时生成的主要有机副产物有2-溴丙烷和___▲___。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是____▲____。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是____▲____。
(5)步骤4中用5% Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12mL 5% Na2CO3溶液,振荡,____▲____,静置,分液。